简介
美国食品药品监督管理局(FDA)的审评流程包括多个标准操作程序(Standard Operating Procedures, SOPPs),这些程序详细规定了各类药品和生物制品的审评流程。以下是对FDA审评流程中SOPPS的简介:
1. IND审评流程:新药临床试验申请(IND)是药品开发早期的重要步骤,允许尚未上市的新药进行人体临床试验。IND审评过程包括行政处理、初步审查、与申办者的沟通、临床暂停令的行政处理等 。
2. ANDA审评流程:简略新药申请(ANDA)是用于仿制药的审评流程,ANDA审评包括化学、微生物、生物等效性审评以及标签说明书的审评。ANDA的审评流程由CDER下属的OGD负责,并与执法部、药政事务办公室共同完成审批 。
3. NDA审评流程:新药上市申请(NDA)是药品上市前的最后一步,要求申办者提供足够的数据证明药品的安全性和有效性。NDA审评流程包括提交申请、技术审评、可能的现场检查、审评委员会会议以及最终的批准或拒绝 。
4. BLA审评流程:生物制品许可申请(BLA)是生物制品上市的申请流程。BLA审评流程包括对生产工艺、化学、药理学、临床药理学和医学影响方面的评估 。
5. 共识标准:FDA认可的共识标准是用于医疗器械、药品等产品审评的重要参考。制造商可以根据这些标准声明其产品符合特定的性能和安全要求,但有时FDA会要求提供额外的试验数据以证明符合性 。
6. 行政处理流程:SOPPS还涵盖了如BLA和NDA的行政处理流程,包括申请的接收、审查、与申办者的沟通、以及最终的批准或拒绝。这些流程旨在确保审评的效率和透明度 。
这些SOPPS为FDA的工作人员提供了审评各类申请的指导,同时也为申办者提供了准备和提交申请的参考。通过遵循这些标准操作程序,FDA确保了药品和生物制品的审评流程既科学又系统。
操作介绍
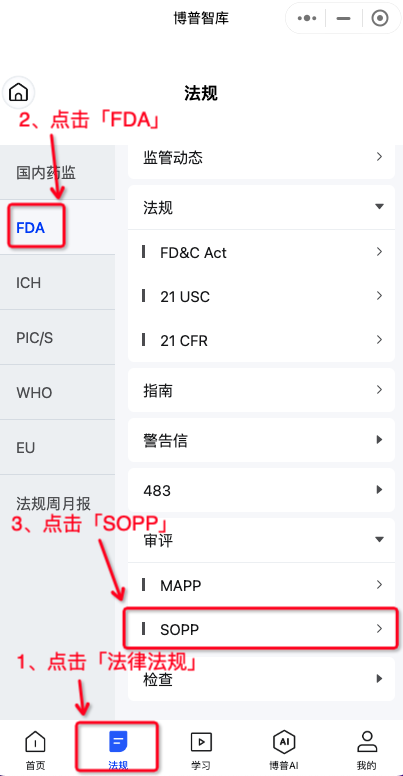
图1-法律法规首页
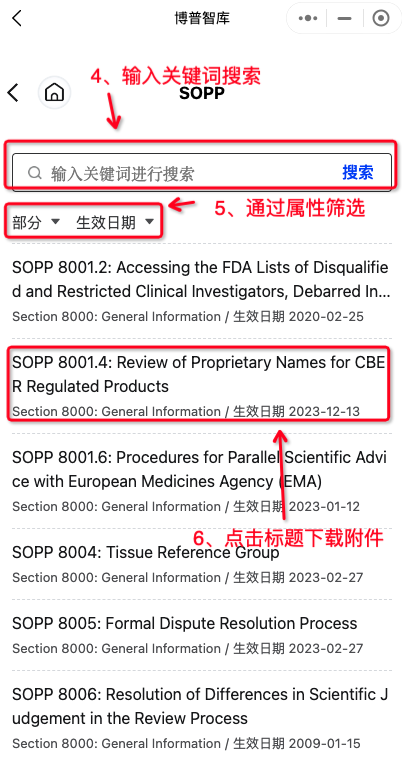
图2-SOPP列表

