功能入口
ICH指导原则简介
ICH是一个由欧洲、日本和美国的药品监管机构、制药行业组成的国际组织。ICH的目标是通过协调和统一全球范围内药品注册要求和指南,促进全球药品开发和注册的国际化,推动药品质量、安全性、效果和效能的提高。ICH的指导原则被广泛接受,影响了全球药品注册和审批的标准。
ICH的指导原则是指由ICH制定的一系列技术要求指南。这些指南旨在协调和统一全球范围内药品注册要求和规范,以促进药品开发、注册和监管的国际化。ICH的指南涵盖了药理学、药代动力学、质量控制、安全、效能等方面,帮助制药行业遵循统一的标准进行药品研发和注册申报,以确保药品质量、安全性和有效性符合国际标准。
ICH的指导原则分为Q、S、E、M四个系列。
Q系列(Quality Guidelines)涵盖了药品质量控制方面的内容,包括药材、药品、生物制品和辅料等方面的要求。
S系列(Safety Guidelines)涵盖了药物的非临临床安全性评价,包括毒理学、药物相互作用、不良反应报告等内容。
E系列(Efficacy Guidelines)涵盖了药物临床试验的设计、执行和评价,包括试验设计、数据分析、生物等价性等内容。
M系列(Multidisciplinary Guidelines)涵盖了包括生物类似药物在内的多样性主题,包括生物类似药物评价、生物制品的共享和核查等内容。
ICH指导原则工具
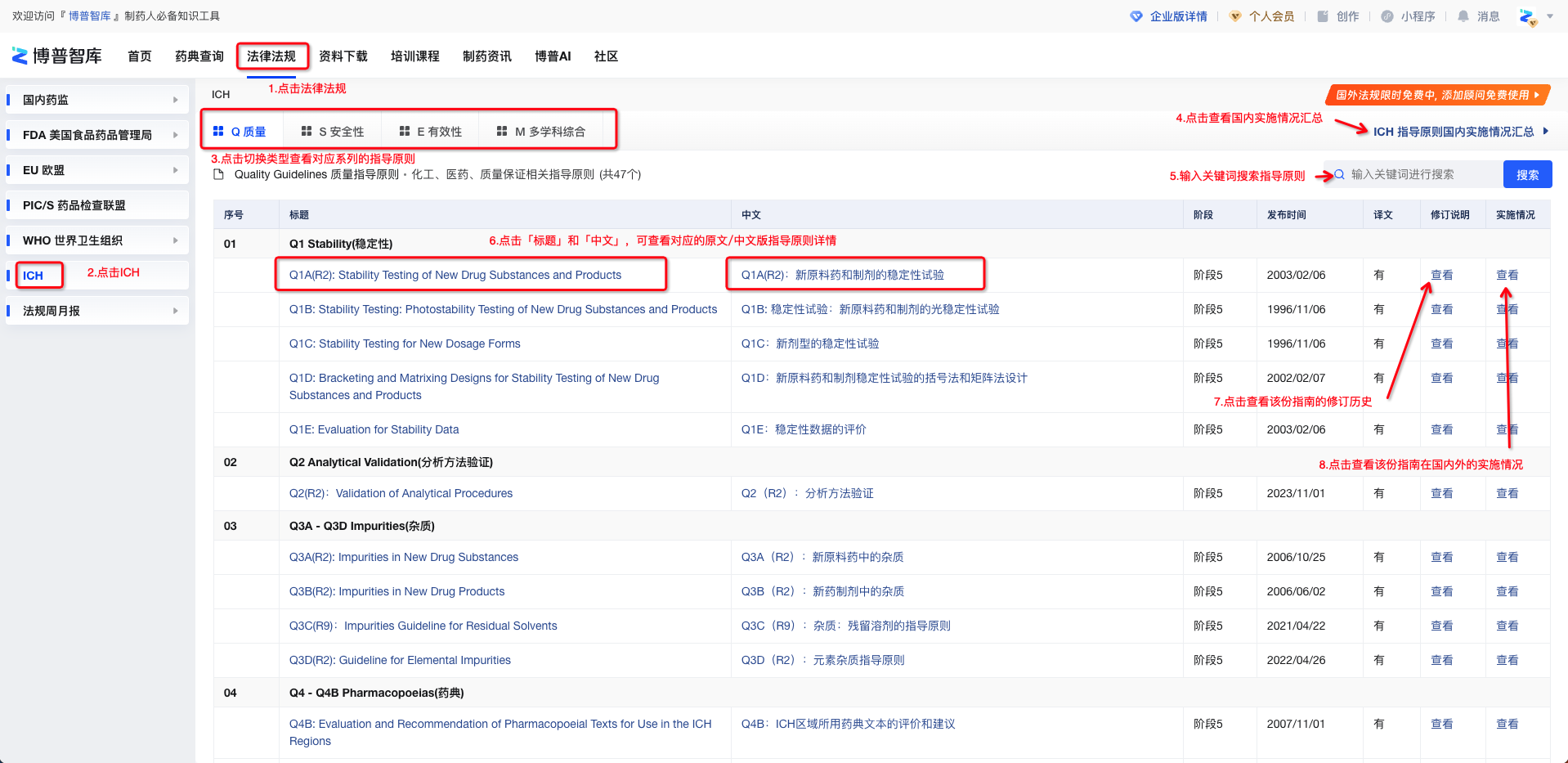
在博普智库ICH指导原则工具列表页,可切换类型查看对应系列的指导原则,也可按关键词检索数据。
点击「ICH国内实施情况汇总」,可查看ICH指导原则在国内实施情况的汇总。
点击「标题」和「中文」,可查看对应的原文/中文版指导原则详情。
点击「修订说明」,可查看该份指南的修订历史。
点击「实施情况」,可查看该份指南当前在国内外的实施情况。