483简介
483是指美国食品药品监督管理局(FDA)发出的《观察记录表》(Form FDA 483),通常简称为“FDA 483”。
在FDA进行现场检查后,查员认为发现了对产品质量或合规性构成潜在风险的问题,他们会在检查结束时向受检单位发出FDA 483报告。这份报告列出了发现的问题、违规行为或不合规情况,要求受检单位采取纠正措施。FDA 483不代表违规、是一种警告,提示受检单位需要立即采取措施纠正问题,以确保产品的安全性、质量和符合法规。
483检查结果分为NAI、VAI、OAI三类,反映了FDA对企业合规性的评估结果。
分类一:NAI(No Action Indicated ),这一分类表示检查人员没有发现违规行为或重大问题,受检单位在本次检查中符合了FDA的要求,没有需要纠正的问题。
分类二:VAI(Voluntary Action Indicated),这一分类表示检查人员在现场检查中发现了一些问题或违规行为,但这些问题并不涉重大的合规性问题,需要采取自愿性的纠正措施。受检单位需要主动采取措施来解决这些问题,以符合FDA的要求。
分类三:OAI(Official Action Indicated),这一分类表示检查人员在现场检查中发现了严重的违规行为或合规性问题,需要采取正式的行政行动来加以解决。这可能包括警、产品召回、罚款、停产等措施,以确保受检单位在法规要求下进行有效纠正。
受检单位收到FDA 483后,通常需要向FDA提交一份书面回复,说明他们计划如何纠正发现的问题,并采取什么措施确保未来的合规性。FDA会对这些回复进行评估,并根据受检单位的反应和采取的措施决定是否需要进一步的监督、制裁或其他行动。
博普智库483查询工具
博普智库483工具汇集了FDA官方公布的483检查信息、483检查报告,并对公布的483检查信息做了可视化的图表分析。接下来,跟我一起详细了解如何使用483查询工具吧。
在博普智库-法律法规板块,左侧菜单选择FDA美国食品药品管理局-483,即可进入483查询工具。
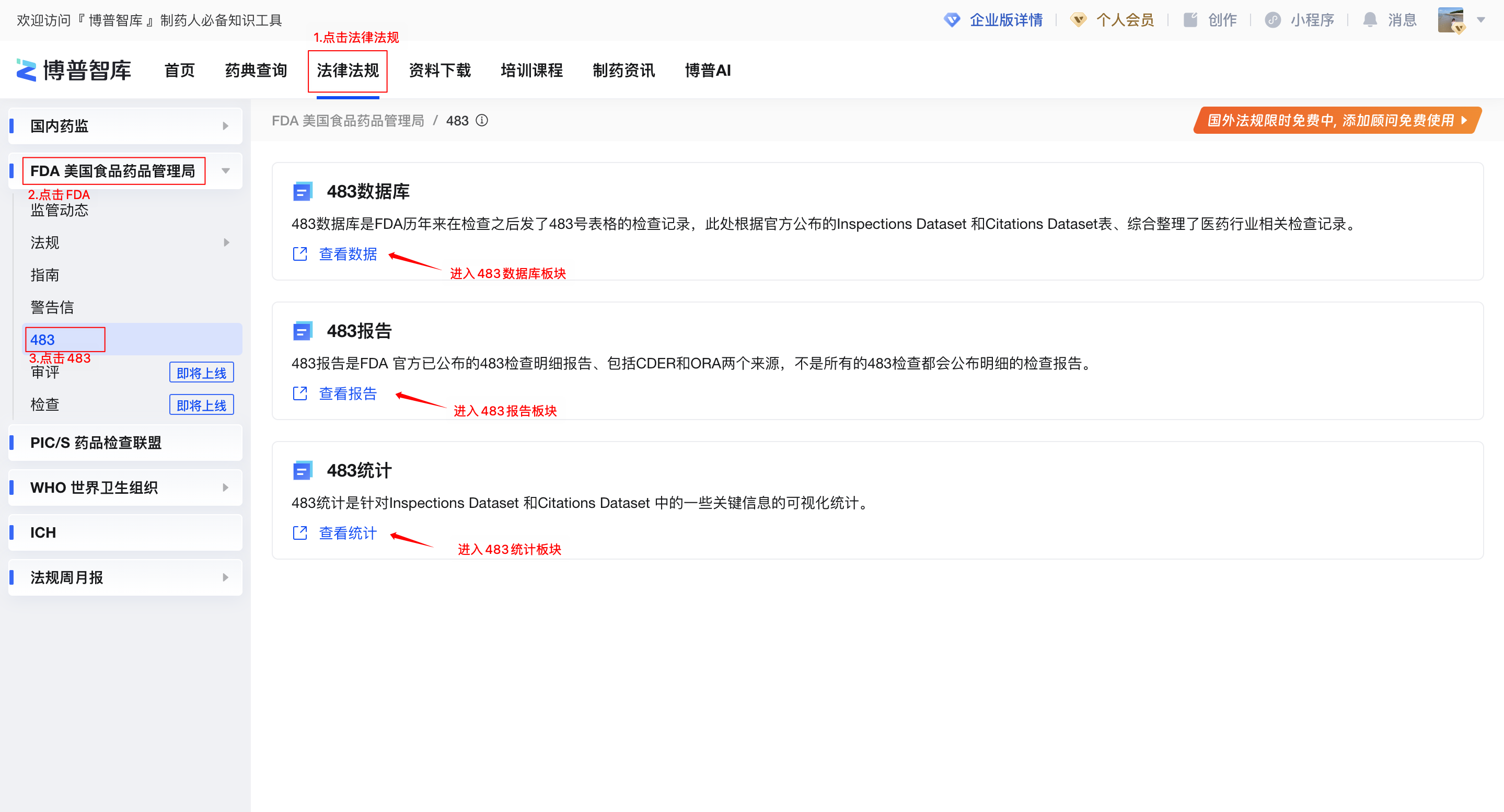
图1-483查询工具
1.483数据库
483数据库是FDA历年来在检查之后发了483号表格的检查记录,此处根据官方公布的Inspections Dataset 和Citations Dataset表、综合整理了医药行业相关检查记录。
Inspections Dataset指的是美国食品药品监督管理局(FDA)公开的数据集,其中包含了FDA对企业进行现场检查(inspection)后所发现的《观察记录表》(Form FDA 483)的信息。这些数据通常包括被检查企业的名称、地址、检查日期、发现的问题描述、问题严重程度等详细信息。查阅FDA 483的Inspections Dataset可以帮助制药企业了解行业内的趋势和常见问题,以及避免类似的问题发生在自己的企业中,有助于企业提高自身的合规性和质量管理水平。
在博普智库483数据库可按条件和关键词快速检索内容。
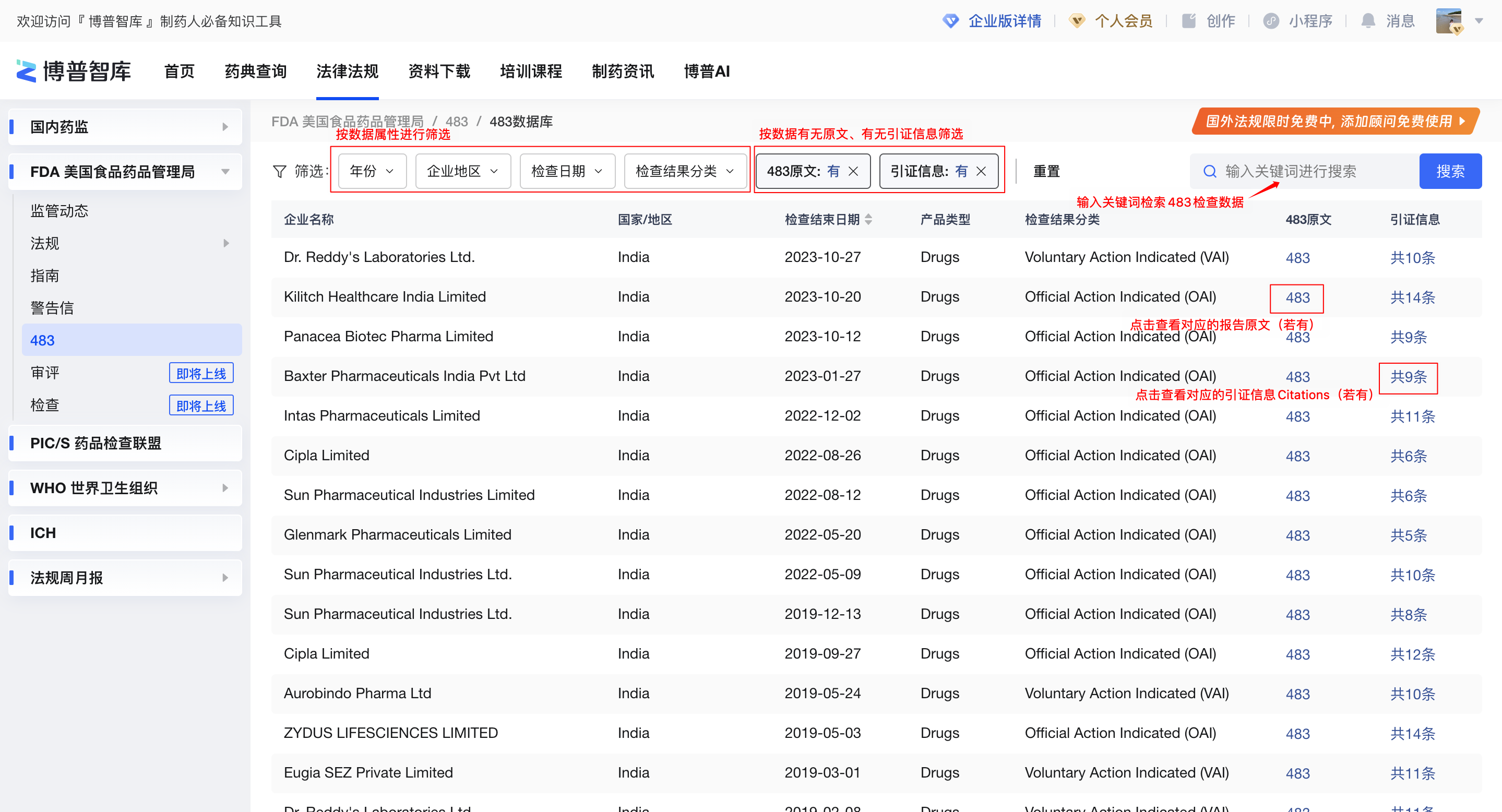
图2-483数据库列表
2.483报告
483报告是FDA 官方已公布的483检查明细报告、包括CDER和ORA两个来源,不是所有的483检查都会公布明细的检查报告。
在博普智库483报告列表页可按条件和关键词快速检索数据,点击「企业名称」可查看483报告详情。
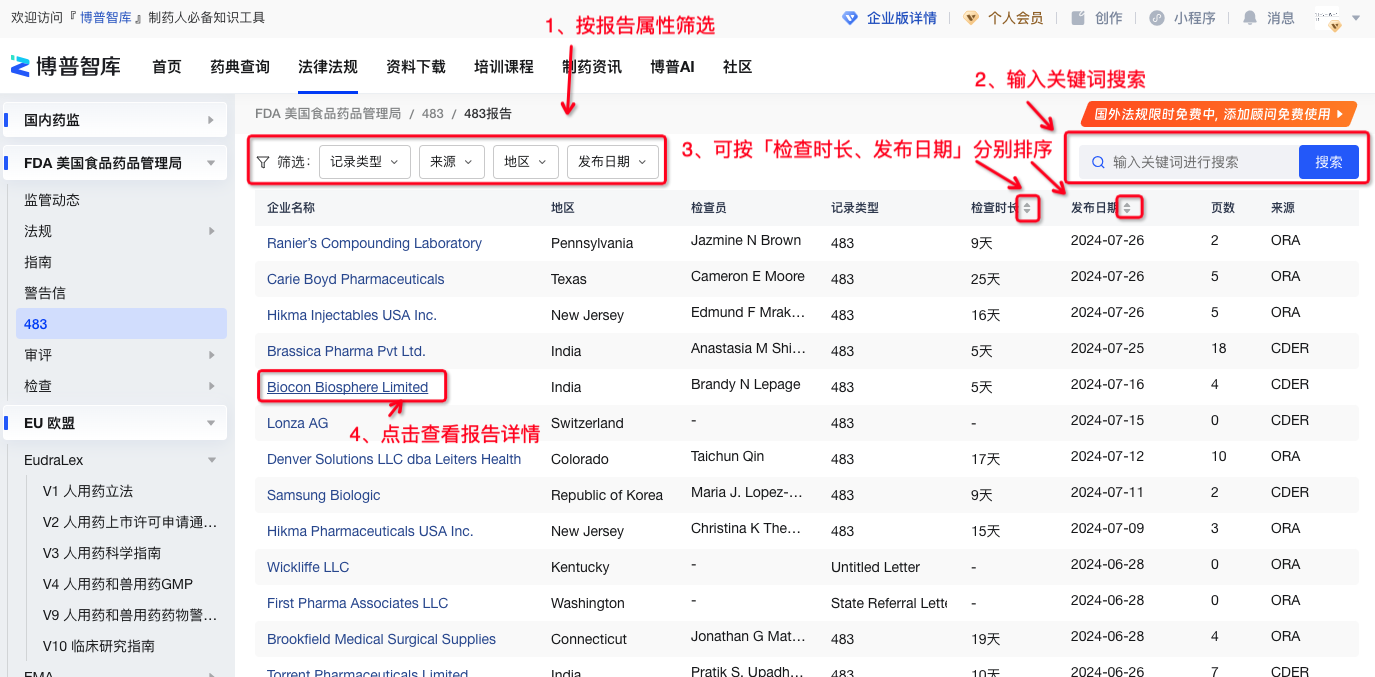
图3-483报告列表
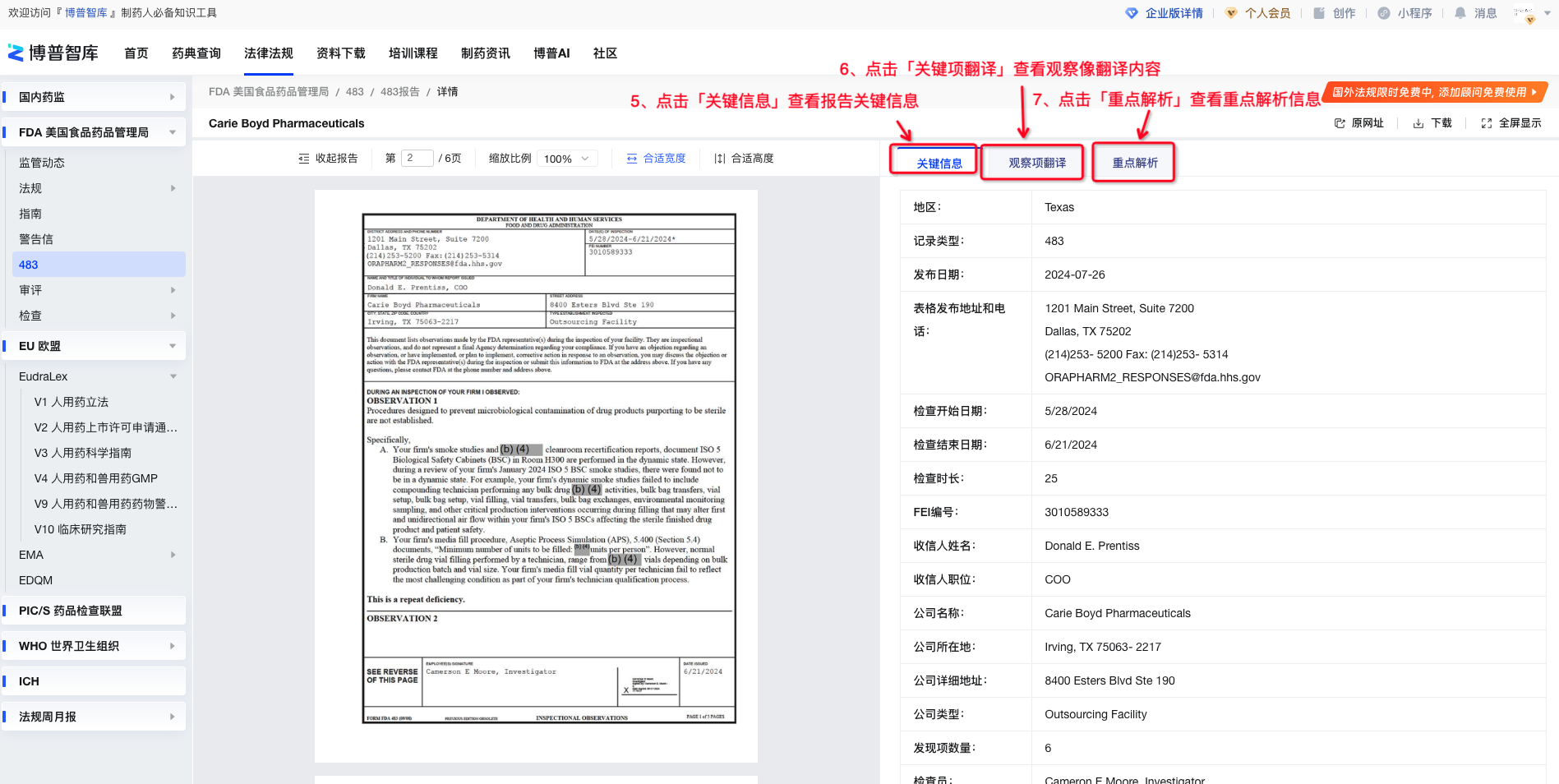
图4-483报告详情
3.483统计
483统计是对Inspections Dataset 和Citations Dataset 中的一些关键信息的可视化统计。
Foreign Inspections指的是FDA对美国本土之外的生产企业进行的现场检查数量以及检查发现的问题、违规行为等相关信息,此处是海外检查各国家的检查数量统计。
Inspections Classification by Fiscal Year指的是根据财政年度对FDA进行的检查(Inspections)结果分类的统计,可以据此了解在不同财政年度中FDA的检查情况、趋势变化以及不同类别的检查结果分布情况。
Inspections Classification by Product Type指的是根据产品类型对 FDA 进行的检查结果进行分类统计。这些产品类型可以包括药品(Drug)、医疗器械(Medical Device)、食品(Food)等不同种类的产品。通过此统计,可以了解在不同类型的产品中 FDA 的检查结果分类情况。
Top 10 Citations指的是对受检查单位在现场检查中发现的违规或不合规行为的统计排名。这些统计通常显示最常见或最严重的违规行为,可以帮助监管机构、企业和公众了解行业中存在的主要问题以及需要重点关注的领域。
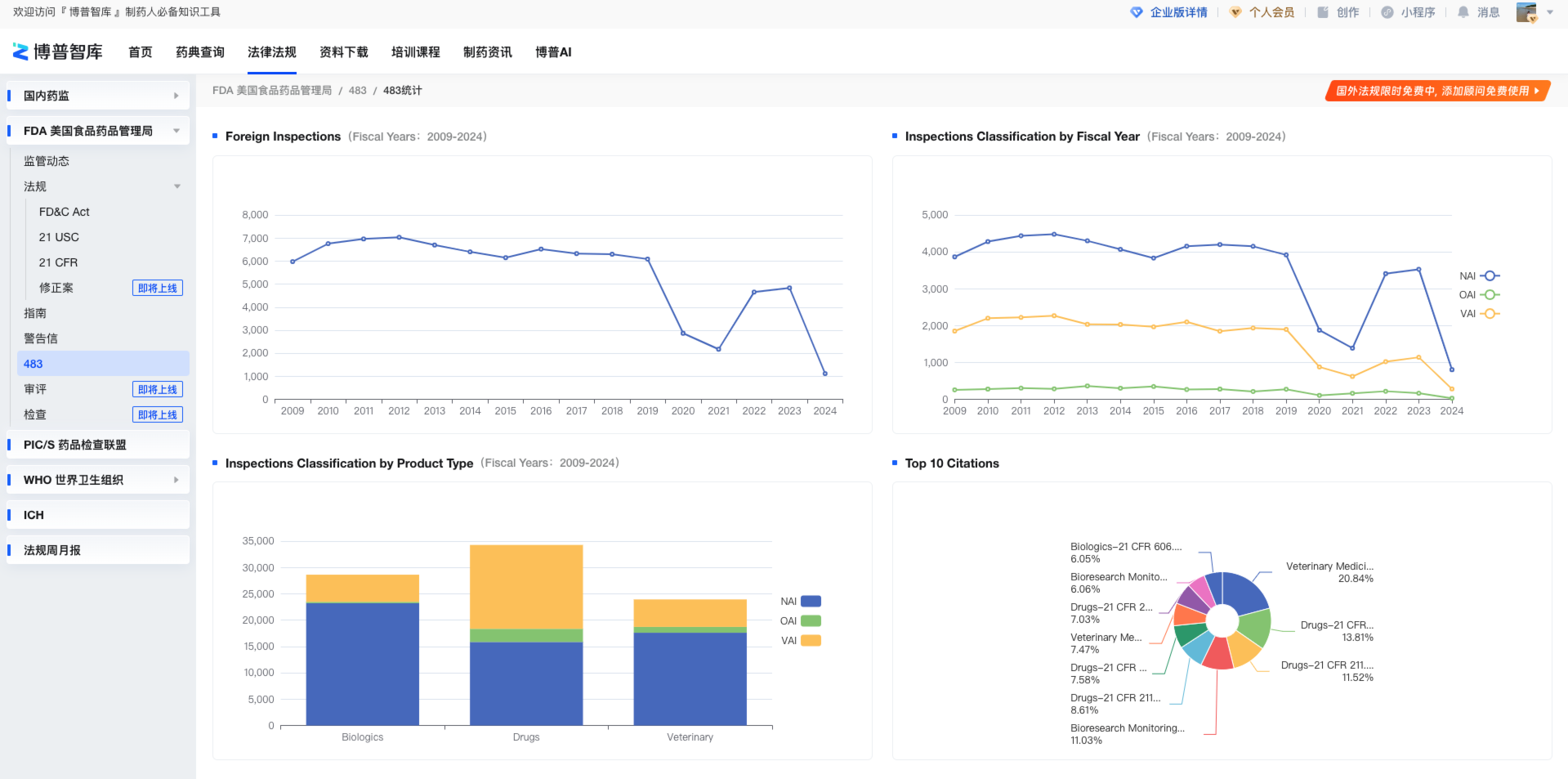
图5-483统计

